Actualités d'Euraxi
Focus Règlementaire Fast-Track Essais Cliniques.
La France s’engage avec un dispositif fast-track pour accélérer les autorisations d’essais cliniques.
La France soutient activement la dynamique européenne visant à l’accélération et à la simplification de la recherche clinique, en cohérence avec le plan France 2030.
Dans ce contexte, l’Agence nationale de sécurité du médicament (ANSM), la Commission nationale des recherches impliquant la personne humaine (CNRIPH) et la Conférence nationale des comités de protection des personnes (CNCP), annoncent la mise en place à compter du premier trimestre 2026 d’un nouveau dispositif accéléré d’autorisation (fast-track) pour certains essais cliniques conduits sur le territoire national.
Cette initiative vise à renforcer l’attractivité de la recherche clinique et à faciliter pour les patients, l’accès prioritaire et sécurisé aux traitements innovants.
Le succès de cette démarche d’accélération repose sur une mobilisation et la responsabilisation de tous les acteurs :
Promoteurs, investigateurs, établissements de soin, autorités réglementaires, comités de protection des personnes (CPP), patients et associations de patients, pouvoirs publics et institutions, experts et sociétés savantes.
L’accélération des autorisations des essais cliniques s’appuie sur un cadre rigoureux et maintes fois éprouvé, qui garantit à la fois la sécurité des participants et la qualité scientifique des essais et de leur évaluation.
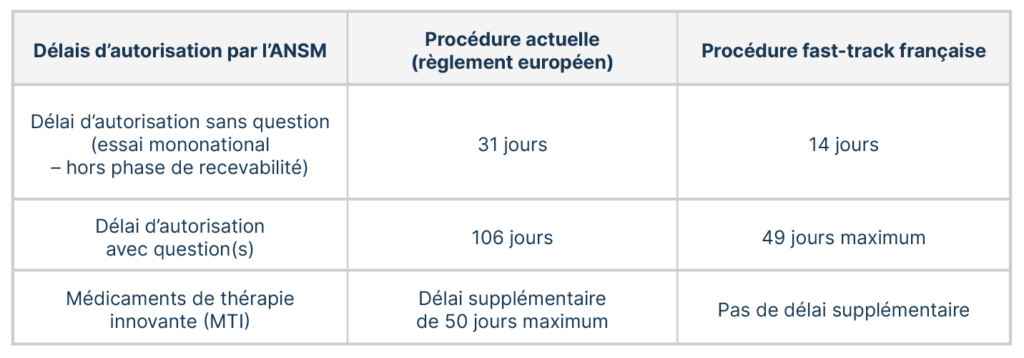
La nouvelle procédure fast-track nationale : vers une autorisation en 14 jours
Le dispositif fast-track offrira aux promoteurs académiques et industriels une voie accélérée pour certaines catégories d’essais cliniques mononationaux :
- Essais en phases précoces (I ou I/II intégrées)
- Et essais mononationaux répondant à au moins un des critères suivants :
- Portant sur une maladie grave, rare ou invalidante, sans traitement approprié disponible
- Et/ou first-in-class , c’est-à-dire ciblant un traitement dont le mécanisme est entièrement nouveau
- Et/ou favorisant l’inclusion d’adolescents dans des essais d’adultes.
Le processus comprendra une vérification par l’ANSM de l’éligibilité de l’essai au dispositif accéléré en amont de la soumission de la demande d’autorisation via le portail CTIS (Clinical Trial Information System), suivie d’une évaluation dans un délai considérablement réduit.
Le délai d’autorisation en fast-track pourra ainsi être de 14 jours si le dossier du promoteur ne soulève pas de question à l’issue de l’évaluation par l’ANSM et le CPP.
Ce mode opératoire sera expérimenté au cours d’une phase pilote dans un premier temps.
Une double évaluation
Depuis le 31 janvier 2022, le règlement européen n° 536/2014 encadre la conduite des essais cliniques sur les médicaments à usage humain. Toutes les demandes d’autorisation doivent être déposées via le portail européen CTIS, qui centralise les soumissions pour l’ensemble des États membres de l’Union européenne.
L’autorisation d’un essai clinique reste assise sur une double évaluation. En France, l’ANSM évalue les aspects scientifiques, méthodologiques et réglementaires du protocole et un comité de protection des personnes (CPP) examine ses dimensions éthiques. Si les deux évaluations sont positives, l’autorisation administrative de réaliser l’essai est délivrée.
Délais d’autorisation : comparaison entre la procédure actuelle et le fast-track.